La alteración de la homeostasis de la insulina abarca tanto a la hiperinsulinemia como a la hipoinsulinemia. Aunque esta última está bien reconocida como diabetes tipo 1, hay poca literatura sobre la primera, a pesar de ser la que primero recibió una hipótesis a principios de la década de 1920. Actualmente, una aproximación cercana a la investigación que se llevó a cabo sobre la hiperinsulinemia es la resistencia a la insulina. Está bien establecido que la resistencia a la insulina subyace en muchas condiciones de salud crónicas importantes como:
- diabetes tipo 2
- síndrome metabólico
- enfermedades cardiovasculares
- algunos tipos de cáncer
- enfermedad de Alzheimer.
Esta resistencia a la insulina se acompaña invariablemente de una mayor demanda de insulina para que el cuerpo pueda mantener la euglucemia. En este trabajo los autores sostienen que la hiperinsulinemia junto con la resistencia a la insulina debe ser considerada como un riesgo de salud independiente importante. Se excluyó a la hiperinsulinemia aislada, como la causada por un insulinoma.
La hiperinsulinemia precede a la hiperglucemia hasta en 24 años
Es bien sabido que la detección precoz de cualquier estado de la enfermedad permite obtener los mejores resultados posibles. Se acuerda que la hiperinsulinemia precede a la hiperglucemia hasta en 24 años. Hay un argumento fuerte a favor de que la hiperglucemia indica el agotamiento de las células β del páncreas; esencialmente en la etapa final del órgano.
Los autores sostienen que la falta de reconocimiento de la hiperinsulinemia es un problema clínico importante porque no hay valores de referencia estándar para su diagnóstico. Se diagnostica con mayor precisión midiendo la glucemia y haciendo la prueba dinámica a la insulina; tiene pocas opciones de tratamiento (farmacológico).
La primera vez que se teorizó sobre la hiperinsulinemia fue en 1924, pero no fue hasta la década de 1960 que las mediciones directas de la insulina fueron posibles. Desde entonces ha habido una gran cantidad de investigación en el campo de la resistencia a la insulina, pero poca sobre la hiperinsulinemia. Por lo tanto, se destacan los estados de enfermedad que se asocian directamente y/o indirectamente con la hiperinsulinemia. En este trabajo también se discute la disponibilidad y las limitaciones de los métodos de diagnóstico actuales para la hiperinsulinemia y por qué se necesitan más investigaciones.
Definición de hiperinsulinemia
No existe una definición precisa de la hiperinsulinemia. A menudo se describe como “más insulina de lo normal para lograr la euglucemia”; esencialmente es la misma que la de la resistencia a la insulina. Cuando se dispone de un rango de referencia, normalmente se basa en los niveles en ayunas: 5-13 µU/ml, ≤ 30 µU/ml y 18 a 173 pmol/l (3-28 µU/ ml).
Sin embargo, hay muy pocos estudios en los que un “nivel normal de insulina” se define como muchos estudios definen a la hiperinsulinemia, basada en cuartiles. Algunos estudios han sido más específicos. Se han propuesto 2 valores: insulinemia en ayunas ≥12,2 µU/ml en presencia de euglucemia y, un rango de 8-11 µU/ml “entre las comidas,” y hasta 60 µU/ml “posprandial”. También hay cuestiones de la práctica metodológica en cuanto a la determinación de la resistencia a la insulina según las condiciones de la OMS.
Etiología
Hasta el momento, la etiología de la hiperinsulinemia no ha quedado establecida por completo. Aunque existen varias teorías, es probable que las investigaciones muestren una patología multimodal. Lo que se puede deducir de los principios fisiológicos es:
- Las células sanas son sometidas a la hiperglucemia aguda
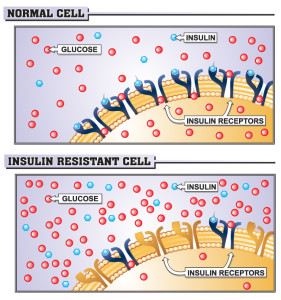
- Aunque muchas células pueden absorber la glucosa sin necesidad de utilizar la insulina (transporte GLUT1), la hiperglucemia provoca la liberación de insulina de las células pancreáticas para facilitar esa absorción, especialmente en las células musculares y adiposas (transporte GLUT 4)
- La insulina se une a los receptores celulares de insulina y facilita la translocación de GLUT4 a la superficie celular. Durante este proceso, la insulina y su receptor son absorbidos por la célula para ser reemplazados por el conjunto de receptores de insulina internos.
- Esta resistencia aguda a la insulina no tiene ninguna consecuencia, siempre y cuando la célula tenga GLUT4 viable en la superficie celular. Sin embargo, GLUT4 tiene una vida media relativamente corta.
- Si la hiperglucemia persiste, el páncreas mantiene la secreción de insulina. Esto puede agotar los receptores de insulina más rápido de lo que pueden ser reemplazados.
- Durante este período, en el cual los receptores celulares de insulina son reemplazados, la hiperglucemia moderada (como la que se halla inmediatamente después de una comida normal) puede necesitar niveles de insulina ligeramente superiores a los normales para retornar la glucemia a su valor normal. Esta hiperinsulinemia moderada puede retrasar el restablecimiento de la función normal del receptor de insulina (resistencia a la insulina aguda).
- Este estado de resistencia a la insulina debido a la regulación a la baja de los receptores de insulina es reversible si la persona no se somete a nuevos episodios de hiperglucemia. No importa si esto es a través de las elevaciones marcadas pero agudas de la glucemia o a las elevaciones moderadamente elevadas durante lapso prolongado. La alteración prolongada de la señalización de la insulina impide la translocación de GLUT4 a la superficie celular alterando la absorción de la glucosa y prolongando la hiperglucemia, dando lugar a un ciclo de retroalimentación positivo. Esto tanto agrava como prolonga la resistencia a la insulina, lo que podría convertir al mencionado estado transitorio en estado persistente o crónico.
La complejidad de la regulación del receptor de insulina combinado con la disponibilidad de los transportadores de glucosa (GLUT) y los factores que influyen en la secreción de insulina significa que es imposible generalizar si la resistencia a la insulina precede o sigue a la hiperinsulinemia. Es más admisible que diferentes personas tengan diferentes factores desencadenantes en el ciclo. Estos desencadenantes pueden ser factores genéticos, exceso de carbohidratos, corticosteroides (endógenos o exógenos), ácidos grasos libres, leptina o ciertos medicamentos.
Fructosa: La fructosa se metaboliza en el hígado en ATP y/o triglicéridos, en un proceso competitivo, preferentemente con la glucosa. Si se consume fructosa en exceso, la glucosa no se metaboliza causando hiperglucemia y la posterior hiperinsulinemia. La fructosa excesiva también resulta en hiperuricemia que se asocia con la reducción del óxido nítrico endotelial, provocando vasoconstricción, disfunción endotelial y resistencia a la insulina.
Hiperglucemia: la hiperglucemia por sí sola también puede agravar aún más la resistencia a la insulina. Junto con la ingesta excesiva de hidratos de carbono, intervienen otros mecanismos de resistencia a la insulina hepática. El aumento de la insulina plasmática disminuye la gluconeogénesis hepática, pero este proceso puede verse afectado por la resistencia a la insulina hepática que conduce a la hiperglucemia periférica y a más secreción de insulina.
Corticosteroides: se sabe que los corticosteroides, especialmente el cortisol endógeno, causan una regulación a la baja de los receptores de GLUT4, evitando así la absorción de glucosa y provocando hiperinsulinemia en presencia de hiperglucemia. Los cursos prolongados de corticosteroides exógenos, como la prednisona, provocan la diabetes tipo 2 ‘inducida por fármacos, que puede resolverse al suspender el medicamento. No todos los pacientes tratados con corticosteroides a largo plazo desarrollan diabetes inducida por el fármaco. Por lo tanto, es posible que el grado de resistencia inicial a la insulina influya en el desarrollo y la progresión de la enfermedad. Dado que el estrés aumenta el nivel de cortisol, también es posible que el estrés prolongado sea otra causa de hiperinsulinemia.
Leptina: El control del apetito está mediado por el hipotálamo en respuesta al equilibrio entre la leptina y la expresión del neuropéptido Y que controla la insulina. Se cree que este equilibrio es importante para el manejo de la ingesta calórica durante lapsos más prolongados, cuando las comidas pueden variar en cantidad, frecuencia y composición. La secreción de leptina cambia lentamente, ya sea por la influencia de la masa total de grasa corporal o la ingesta calórica total, mientras que la secreción de insulina es muy sensible al consumo de alimentos y cambia rápidamente con cada comida. La leptina también está muy influenciada por la insulina, ya que se libera de las reservas de grasa, a través de mecanismos que parecen depender del flujo de glucosa: La evidencia experimental muestra que la reducción de la secreción de insulina reduce la resistencia a la leptina, lo que sugiere una relación entre la hiperinsulinemia y la hiperleptinemia. Aún no está claro si la hiperleptinemia causa hiperinsulinemia, aparte de su asociación con la obesidad y el aumento en los ácidos grasos libres.
Inducida por medicamentos: Hay una serie de medicamentos que son conocidos o sospechosos de causar hiperinsulinemia y/o que contribuyen a la resistencia a la insulina. Se han examinado los mecanismos de acción de los corticosteroides exógenos (prednisona), la insulina exógena y los secretagogos de insulina (sulfonilureas), así como los antipsicóticos (por ej., la clozapina) y las estatinas. Actualmente, se desconocen los mecanismos por los que estos medicamentos causan hiperinsulinemia.
Debido a la naturaleza de la regulación del receptor de insulina, también es plausible que se pueda restaurar la sensibilidad celular a la insulina. Esto requeriría la ausencia tanto de hiperinsulinemia como de hiperglucemia.
Los estudios de casos indican que una dieta restringida en carbohidratos puede facilitar este efecto. En general, se debe reconocer que la hiperinsulinemia es independiente de la resistencia a la insulina: la hiperinsulinemia es la secreción excesiva de insulina, mientras que la resistencia a la insulina es la absorción alterada de la glucosa.
Esta revisión investiga la evidencia de causas físicas y biológicas y la evidencia epidemiológica que relaciona la hiperinsulinemia con las enfermedades metabólicas. Aunque hay investigaciones de buena calidad que relacionan las causas físicas y biológicas de la hiperinsulinemia con las patologías posteriores, la evidencia epidemiológica es escasa y de baja calidad. Dada la naturaleza entrelazada entre la resistencia a la insulina y la hiperinsulinemia, se puede suponer que la mayoría de las personas con resistencia a la insulina también tienen hiperinsulinemia. Por lo tanto, al no haber datos epidemiológicos disponibles, esta revisión utilizó la investigación epidemiológica de la resistencia a la insulina como una aproximación para la hiperinsulinemia.
Efectos directos de la hiperinsulinemia
La hiperinsulinemia puede estar relacionada epidemiolólgicamente y por sus causas físicas y biológicas con el síndrome metabólico, la diabetes gestacional y la diabetes 2 y, por lo tanto, con las enfermedades cardiovasculares y otras enfermedades con mayor prevalencia en los pacientes con síndrome metabólico. Este también es un factor de riesgo independiente de una serie de condiciones como la obesidad inducida por la dieta, la artrosis, ciertos tipos de cáncer, especialmente de mama y de colon y recto y, la enfermedad de Alzheimer y otras demencias.
Otras condiciones que pueden estar asociadas a la hiperinsulinemia son la gota, el tinnitus, la esquizofrenia, y el autismo. Se necesita más investigación para confirmar estas asociaciones.
Mecanismos fisiopatológicos
La hiperinsulinemia afecta al cuerpo a través de 5 mecanismos principales:
- aumento de las especies oxidativas reactivas y productos finales de la glicación avanzada
- aumento del factor de crecimiento símil insulina 1 (IGF-1)
- hiperglucemia
- aumento de la /producción de ácidos grasos y triglicéridos
- afectación de diferentes hormonas y citocinas.
Especies oxidativas reactivas
Especies reactivas de oxígeno es un término colectivo que incluye tanto a los radicales oxígeno como a los agentes oxidantes no radicales como el peróxido de hidrógeno. Las especies oxidativas reactivas también se producen y participan en muchos procesos metabólicos, como las reacciones enzimáticas, la expresión génica y la señal de transducción. Generalmente, las acciones de los agentes reductores intracelulares como los antioxidantes previenen el daño mediado por las especies oxidativas reactivas. Sin embargo, una serie de factores puede contribuir a la producción excesiva de especies oxidativas reactivas incluyendo el consumo excesivo de calorías y la presencia de diversos mediadores proinflamatorios, como el factor de necrosis tumoral α.
Una vez producidas, las especies oxidativas reactivas pueden interactuar con numerosos componentes celulares como el ADN, los lípidos y los aminoácidos. Es probable que el daño al ADN sea el mecanismo subyacente para que las especies oxidativas reactivas se asocien con el cáncer y el envejecimiento precoz.
Los ácidos grasos poliinsaturados se consideran muy susceptibles al daño de las especies oxidativas reactivas, lo que provoca la peroxidación lipídica, que puede afectar la fluidez y la integridad de la membrana celular, siendo el mecanismo potencial del daño endotelial. Los aminoácidos como la cisteína y la metionina son muy susceptibles al daño de las especies oxidativas reactivas. Los cambios en estos aminoácidos intervienen en el desarrollo de la enfermedad de Alzheimer.
La hiperinsulinemia se asocia con un aumento de las especies oxidativas reactivas, aunque el mecanismo exacto todavía está en discusión. La hiperinsulinemia está vinculada a la hiperglucemia y a los ácidos grasos libres. Cualquier sustrato puede causar un aumento de la producción de especies oxidativas reactivas. También se ha demostrado que la insulina tiene algunos efectos inhibidores sobre la producción de especies oxidativas reactivas, que pueden ser independientes de sus efectos sobre la glucosa en sangre. Sin embargo, también se cree que la reducción de la absorción de nutrientes estimulada por la insulina en la célula disminuiría la producción de especies oxidativas reactivas. Se requiere más investigación para entender mejor estos mecanismos.
También se cree que el exceso de nutrición es responsable de la formación de productos finales de la glicación avanzada a través de la glicación no enzimática y del proceso de glucooxidación. La excreción renal defectuosa de los productos finales de la glicación avanzada, como sucede en la nefropatía diabética, y el consumo de productos finales exógenos de la glicación avanzada aumentan el nivel de los productos plasmáticos finales de la glicación avanzada. Se cree que los productos finales de la glicación avanzada favorecen los cambios en los sistemas microvasculares y promueven alteraciones inflamatorios, oxidativas, y otros procesos degenerativos de varias enfermedades crónicas, incluyendo las neuropatías.
Factores de crecimiento (IGF, factor de crecimiento endotelial vascular)
La insulina, el IGF-1 y otras sustancias como el factor de crecimiento endotelial vascular pueden estimular el crecimiento y la división de muchas células. La insulina puede mediar la división celular, pero también puede estimular la proliferación de células cancerosas y metástasis. Más importante es que la insulina aumenta la biodisponibilidad del IGF-1, por lo que la insulina está implicada indirectamente en todos los procesos mediados por el IGF-1. Estos procesos incluyen alteraciones en las estructuras vasculares, aumento de la división celular y prevención de la apoptosis.
Hiperglucemia
La hiperglucemia comúnmente sigue a la hiperinsulinemia pero hay poca información que indique si la glucosa en ayunas, los picos de glucosa o el área bajo la curva (AUC) tienen un impacto más perjudicial para la salud. Las células cancerosas tienen una absorción elevada de la glucosa en forma continua, lo que favorece el crecimiento y la proliferación celular; la hiperglucemia aumenta este proceso. La hiperglucemia permite que el IGF-1 estimule la proliferación del músculo liso vascular, un sello distintivo del cáncer y la aterosclerosis. La coagulabilidad de la sangre también se incrementa con la hiperglucemia, independientemente del nivel de insulina.
Aumento de los ácidos grasos y los triglicéridos
La hiperinsulinemia influye en la producción de los ácidos grasos libres y los triglicéridos. Si bien los procesos que ocurren durante la lipogénesis hepática de novo no están en disputa, existe debate acerca de si preceden a la hiperinsulinemia o son una consecuencia del hígado graso. Sin embargo, los niveles elevados de triglicéridos son un componente clave del síndrome metabólico mientras que el hígado graso puede ser considerado una manifestación hepática del mismo síndrome, pudiendo progresar a la cirrosis o el cáncer. Los niveles elevados de triglicéridos hepatocelulares también pueden deteriorar aún más la resistencia a la leptina.
Producción de hormonas y citocinas (hormonas sexuales, inflamación, obesidad)
La hiperinsulinemia está involucrada en la adiposidad a través de aumento del apetito y la producción de triglicéridos, aumentando así la adiposidad. En la actualidad, está bien establecido que el tejido adiposo es un órgano endócrino y produce las hormonas y citocinas que se utilizan para la comunicación celular. Los tejidos adiposos hipertróficos activan las vías inflamatorias y el estrés, y disminuyen la respuesta a la insulina. Esto se traduce en un aumento de la producción de citocinas incluyendo el TNF-α, el factor de crecimiento endotelial vascular y la leptina, mientras que la expresión de adiponectina está disminuida. Estas acciones favorecen la disminución de la glucosa y la captación de lípidos, lo que lleva a una mayor reducción de la secreción de adiponectina y a la adipogénesis; también se produce una mayor resistencia a la insulina. La disminución de la absorción de glucosa significa que hay menos glicerol dentro del adipocito para esterificar los ácidos grasos libres, lo que les permite infiltrase y acumularse en otros tejidos.
La adiponectina disminuye la proliferación de tipos de células como los adipocitos, las células endoteliales y las células cancerosas. El papel de la leptina aún no se conoce por completo, pero se acepta que la hiperinsulinemia y la hiperleptinemia dan lugar a la resistencia a la leptina central, y al consiguiente impedimento de la supresión del apetito, con la promoción de más obesidad. También está relacionada con el aumento de las citocinas inflamatorias, los cambios en el óxido nítrico y otras lesiones endoteliales.
Asimismo se cree que la hiperinsulinemia eleva los niveles del inhibidor del activador del plasminógeno tipo 1, con el consiguiente aumento de la fibrinólisis y el mayor riesgo de trombosis. Combinada con la hipercoagulabilidad de la hiperglucemia podría explicarse por qué más del 80% de las personas con diabetes tipo 2 muere por episodios trombóticos.
Diagnóstico
Se recomienda que si se solicita la insulinemia en ayunas se utilice la media de 3 muestras tomadas con intervalos de 5 minutos. El diagnóstico de hiperinsulinemia es muy difícil, en parte debido a los efectos combinados de la resistencia a la insulina y la hiperinsulinemia sobre la salud. Al interpretar la literatura disponible surgen otros desafíos.
Como se mencionó anteriormente, los niveles de insulina en ayunas se han evaluado como medio de diagnóstico de la hiperinsulinemia con diferentes resultados. Pero lo problemático es evaluar el nivel de insulina. Cómo y cuándo se efectúa el muestreo también hará que los resultados varíen. Los niveles de insulina son más elevados en el suero que en el plasma lo que significa que los estudios que informaron a la insulina en el suero no pueden ser comparados directamente con los estudios que utilizaron la insulinemia plasmática.
La secreción de insulina es pulsátil y genera niveles importantes de insulina plasmática en un corto lapso. Se recomienda que si se solicita la insulinemia en ayunas se utilice la media de 3 muestras tomadas con intervalos de 5 minutos. Sin embargo, ésto rara vez se hace en la práctica. Las muestras individuales de insulina en ayunas pueden tener un coeficiente de variación del 25 al 50%. Esta variación disminuye la sensibilidad de las pruebas y quizás por esono se recomienda medir la insulinemia en ayunas en la práctica clínica.
Se desconoce si las pruebas de resistencia a la insulina pueden ser utilizadas para diagnosticar la hiperinsulinemia. El estándar de oro para medir la resistencia a la insulina es la prueba de la pinza hiperinsulinémica euglucémica.
El cuartil más bajo de la tasa de captación de glucosa define la resistencia a la insulina para la población en estudio. Las cifras de este cuartil inferior han oscilado entre <4,7 mg/kg/minuto para ≤ 6,3M mU-1 L-1, sin embargo las diferencias en los tipos de insulina para infusión, los cálculos de la tasa de eliminación de la glucosa y los antecedentes de las poblaciones bajo investigación son limitaciones que impiden generalizar estos resultados.
Por otra parte, dada la complejidad del procedimiento, la prueba de la pinza hiperinsulinémica euglucémica tiene poca o ninguna aplicación clínica. Una complicación adicional del uso de la prueba de la pinza para evaluar la hiperinsulinemia es que la infusión de dosis elevadas de insulina confunde cualquier efecto de la secreción de insulina endógena. Como se teorizó antes, el daño asociado a la hiperinsulinemia se debería a la acción continua de la insulina en los tejidos. La cantidad de insulina normalmente presente en los tejidos no se puede medir durante el proceso de fijación. Se desconoce si las tasas de captación de glucosa se correlacionan con la secreción de insulina.
Se han desarrollado una serie de pruebas que se validan con la pinza hiperinsulinémica euglucémica, que tienen una aplicabilidad más clínica.
Las basadas en la insulina en ayunas incluyen un modelo de evaluación homeostásico (HOMA u HOMA2), el Índice McAuley y el índice cuantitativo de sensibilidad a la insulina (QUICKI). Aunque HOMA se ha perfeccionado hasta llegar al modelo HOMA2, ambos son modelos que combinan la insulinemia en ayunas con la glucemia en ayunas. La prueba HOMA original tiene una especificidad del 89% y una sensibilidad del 67% comparada con el test de la pinza hiperinsulinémica euglucémica. El índice McAuley se calcula a partir de la insulinemia en ayunas y los niveles de triglicéridos en ayunas, con 61% de sensibilidad y 85% de especificidad.
Otra prueba de resistencia a la insulina, el índice de sensibilidad a la glucosa oral (ISGO), se calcula sobre los resultados derivados del test de tolerancia a la glucosa oral (TTGO). El ISGO utiliza tanto los niveles de insulina en sangre como los de glucosa, al inicio del estudio, a los 120 min y a los 180 min. El ISGO se valida mediante las evaluaciones de la pinza hiperinsulinémica euglucémica para la resistencia a la insulina, pero como se dijo antes, la generalización de esa prueba es limitada.
Tanto el ISGO como las pruebas basadas en los niveles de insulina en ayunas tienen más aplicación clínica para evaluar la resistencia a la insulina que la prueba de la pinza hiperinsulinémica euglucémica. Sin embargo, las pruebas de resistencia a la insulina no se ha traducido en mejoras en los cálculos del riesgo de enfermedades.
La definición de la OMS para la resistencia a la insulina resulta en que 1 de cada 4 personas podría recibir el diagnóstico de resistencia a la insulina; una cifra que puede no estar relacionada con los riesgos de salud actuales. El análisis de Women´s Health Initiative Biomarkers mostró que a pesar de que HOMA-IR se asoció positivamente con el riesgo cardiovascular, pasó a ser no significativa luego del ajuste por otros factores de riesgo como el colesterol HDL. Se sostiene que para evaluar la resistencia a la insulina se debe usar el HOMA-IR combinado con el HOMA-%B.
Nuevas investigaciones indican que los patrones de respuesta a la insulina después de unacarga oral de glucosa pueden determinar el estado de hiperinsulinemia. Kraft demostró la variabilidad de la respuesta de la insulina a una carga de 100 g de glucosa en 3-5 horas, especialmente con respecto al tiempo y la magnitud del pico de insulina y la tasa de disminución de la respuesta. Se han identificado claramente 5 patrones principales de respuesta a la insulina, correspondiendo el patrón I a la tolerancia a la insulina normal.
En su investigación, Kraft concluyó que el modo más preciso para evaluar la hiperinsulinemia es una prueba de TTGO de 3 horas, evaluando los niveles de insulina al comienzo y como mínimo, a los 30, 60, 120 y 180 minutos, pero también podría considerarse la insulinemia a los 240 y los 300 minutos. Este estudio fue transversal y no hay resultados a largo plazo.
Hayashi y col. han demostrado que el patrón insulinémico establecido a partir de las muestras tomadas cada 30 minutos durante la TTGO de 2 horas puede predecir el desarrollo de diabetes tipo 2. Tanto en el patrón de Kraft como en el de Hayashi, es común la asociación de un pico de insulina retardado más allá de los 60 minutos acompañando a un estado de salud más deteriorado. Se necesita más investigación para entender cómo aplicar estas pautas a la práctica clínica.
En conjunto, estos estudios muestran que hay escasez de investigación para el diagnóstico de hiperinsulinemia. La mayoría de los estudios se centra en las pruebas de resistencia a la insulina, pero se desconoce si la resistencia a la insulina se correlaciona con la secreción de insulina.
Observaciones finales
Esta revisión demuestra claramente que no solo la hiperinsulinemia está involucrada en la etiología de todos los síntomas del síndrome metabólico sino que también está implicada en muchas otras condiciones, algunas de las cuales han sido previamente consideradas como idiopáticas, como el tinnitus. Esto plantea muchas preguntas con implicancias clínicas y de investigación.
En primer lugar, ¿cuál es la prevalencia de la hiperinsulinemia? Dada su asociación con el síndrome metabólico y la esteatosis hepática se justifica su investigación. ¿Podría la detección precoz y el manejo cuidadoso de la hiperinsulinemia disminuir la necesidad de intervenciones médicas más tarde en la vida? ¿Podría el manejo de la hiperinsulinemia mejorar la cantidad y la calidad de vida?
Sin embargo, en la actualidad hay muchas preguntas con respecto al diagnóstico. Esperar un resultado fiable y repetible cuando se muestrea la insulina todavía sigue siendo una tarea difícil. No existe acuerdo sobre el rango de referencia y no solo respecto de las asociaciones entre los cuartiles y el riesgo de enfermedad en curso.
El patrón de respuesta a la insulina puede responder algunas de estas preguntas, pero establecer ese patrón requiere más recursos que el nivel de insulina en ayunas. Dadas las preocupaciones mundiales acerca de la “epidemia” de enfermedades metabólicas, este tema necesita una urgente investigación.
Traducción y resumen objetivo: Dra. Marta Papponetti
Fuente: IntraMed