Aunque se desarrolla con mayor frecuencia en pacientes con linfoma no-Hodgkin o leucemia aguda, su frecuencia está aumentando entre los pacientes con tumores que antes solo rara vez se asociaban con esta complicación. El SLT se produce cuando las células tumorales liberan su contenido en el torrente sanguíneo, ya sea espontáneamente o como respuesta al tratamiento, siendo sus hallazgos característicos la hiperuricemia, la hiperpotasemia, la hiperfosfatemia y la hipocalcemia. Estas alteraciones electrolíticas y metabólicas pueden provocar efectos tóxicos clínicos como la insuficiencia renal, las arritmias cardíacas, las convulsiones y la muerte por fallo multiorgánico.
Aunque ha sido difícil definir cuáles son los métodos de clasificación del riesgo y el tratamiento óptimos, están apareciendo normas uniformes para el manejo de este síndrome. De hecho, varios grupos han abogado por las guías para la clasificación del riesgo y formularon recomendaciones para la evaluación del riesgo y el tratamiento profiláctico del SLT. Esta revisión se limita a las estrategias actuales para la evaluación del riesgo, la profilaxis y el tratamiento del SLT. El caso siguiente ilustra los desafíos clínicos.
Informe de un caso
Un niño de 8 años fue derivado al otorrinolaringólogo para la amigdalectomía después de varios meses de aumento de los ronquidos, fatiga, dolor de garganta, agrandamiento tonsilar y aumento paulatino indoloro de los ganglios cervicales. Dos días antes del procedimiento programado, sus padres lo llevaron al departamento de emergencias local porque no había podido dormir debido a la congestión, el dolor de garganta y la dificultad para respirar. El médico del departamento de emergencia constató congestión nasal, agrandamiento de las amígdalas que alcanzaban la línea media y adenopatías importantes en la zona cervical anterior y posterior. Se le administraron 4 mg de dexametasona por vía intramuscular y se le recetó loratadina. Durante las 36 horas siguientes, el paciente mejoró un poco la congestión y la respiración pero apareció malestar y vomitó varias veces. Regresó al servicio de urgencias donde se comprobó facies descompuesta y deshidratación moderada. La evaluación mostró una leucocitosis de 84.600/mm3, con linfoblastos; natremia 133 mmol/L; potasemia 5,9 mmol/L; bicarbonato, 16 mmol/L; creatininemia, 1,0 mg/dL; fosfatemia, 8,5 mg/dL; calcemia de 6,7/dL; uricemia 12,3 mg/dL y, lactato deshidrogenasa 4.233 UI/L. la radiografía de tórax reveló una masa mediastínal pequeña y el electrocardiograma era normal. Se le administraron dos bolos de solución salina normal (20 ml/kg de peso corporal), rasburicasa (0,15 mg/kg) y 800 mg de hidróxido de aluminio; líquidos intravenosos (2.500 ml/m2 de superficie corporal/día), y fue trasladado en ambulancia a un centro de atención terciaria, donde fue internado en la unidad de terapia intensiva donde se le diagnosticó leucemia linfoblástica aguda de células T. Su evolución se complicó por oliguria, hiperfosfatemia (un máximo de 11,2 mg/dL [3,6 mmol/l] de fósforo, el día 3), un nivel elevado de creatinina (un máximo de 3,8 mg/dL, el día 5) e hipertensión que se resolvió al cabo de 2 meses. No requirió diálisis, y 5 años después del diagnóstico todavía mantenía la remisión.
Definición del síndrome de lisis tumoral
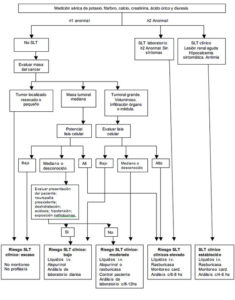
En el actual sistema de Cairo y Bishop, el SLT se puede clasificar sobre la base del laboratorio o la clínica. El SLT de laboratorio requiere que 2 o más de las anormalidades metabólicas (hiperuricemia, hiperpotasemia, hiperfosfatemia e hipocalcemia) ocurran dentro de los 3 días previos o hasta 7 días después de la iniciación del tratamiento. El SLT clínico está presente cuando el laboratorio del SLT se acompaña de un aumento del nivel de creatinina, convulsiones, trastornos del ritmo cardíaco o muerte. Unos cuantos detalles podrían mejorar esta clasificación. En primer lugar, conviene precisar la presencia simultánea de 2 o más alteraciones metabólicas, ya que algunos pacientes pueden presentar una anormalidad y más tarde desarrollar otra que no está relacionada con el SLT (por ej., hipocalcemia asociada a sepsis). Segundo, en contraste con la definición de Cairo y Bishop no se debe considerar un criterio un cambio del 25% desde el inicio, ya que los aumentos raramente tienen importancia clínica a menos que el valor ya esté fuera de los límites normales. Tercero, cualquier hipocalcemia sintomática debe hacer sospechar el STL clínico. Al ingresar al servicio de urgencias, el paciente presentado cumplía con los criterios de laboratorio del STL pero al día siguiente cumplía con los criterios de STL clínico, al detectarse un nivel de creatinina >1,0 mg/dL a 2,1 mg/dl.
| Definiciones de laboratorio y clínica del síndrome de lisis tumoral* | ||
| Anormalidad metabólica | Criterio de clasificación de laboratorio del SLT | Criterio de clasificación clínica del SLT |
| Hiperuricemia | Acido úrico >8 mg/dL en adultos o >del límite superior normal en niños | |
| Hiperfosfatemia | Fósforo > 4,5 mg/dL en adultos o >6,5 mg/dL en niños | |
| HIperpotasemia | Potasio > 6 mEq/L | Arritmias cardíacas o muerte súbita o causada definitivamente por la hiperpotasemia |
| HIpocalcemia | Calcio corregido <7 mg/dL o calcio ionizado <1,12 (0,3 mmol/L) ∞ | Arritmias cardíacas, muerte súbita, convulsiones, irritabilidad neuromuscular (tetania, parestesias, calambres musculares, espasmo carpopedal o, broncoespasmo), hipotensión o, insuficiencia cardíaca probablemente o definitivamente causada por la hipopotasemia |
| Lesión renal aguda ¥ | No aplicable | Aumento de la creatininemia de 0,3 mg/dL (o un valor único >1,5 veces el límite superior normal cuando no se dispone de la creatininemia basal) u, oliguria (diuresis <0,5 ml/kg/hora, durante 6 horas. |
| *En el SLT, deben estar presentes 2 o más alteraciones metabólicas durante el mismo período de 24 horas dentro de los 3 días previos al inicio del tratamiento y hasta los 7 días posteriores. El SLT clínico requiere la presencia del SLT de laboratorio plus el aumento de la creatininemia, convulsiones, arritmias cardíacas o muerte. ∞La calcemia corregida en mg/dL + 0,8(4- albúmina en g/dL) ¥La lesión renal aguda se define como el aumento de la creatininemia de al menos 0,3 mg/dL o un período de oliguria ≥6 horas. Por definición, en presencia de lesión renal aguda, el paciente tiene un SLT clínico. |
||
Fisiopatología
Cuando se produce la lisis, las células cancerosas liberan potasio, fósforo y ácidos nucleicos, que se metabolizan en hipoxantina, luego xantina y, finalmente, ácido úrico, un producto final en el ser humano. La hiperpotasemia puede causar arritmias graves, en ocasiones mortales. La hiperfosfatemia puede causar hipocalcemia secundaria, lo que provoca irritabilidad neuromuscular (tetania), arritmias cardíacas y convulsiones; también puede precipitar fosfato de calcio en varios órganos, en forma de cristales (por ej., en los riñones, donde pueden causar insuficiencia renal aguda). El ácido úrico puede provocar insuficiencia renal aguda no solo por la cristalización intrarrenal sino también por mecanismos independientes relacionados con los cristales, como la vasoconstricción renal, la alteración de la autorregulación, la disminución del flujo sanguíneo renal, la oxidación y la inflamación. El SLT también libera citocinas que causan un síndrome de respuesta inflamatoria sistémica y a menudo falla multiorgánica.
El SLT se produce cuando la cantidad de potasio, fósforo, ácidos nucleicos y citocinas liberados durante la lisis celular no puede ser contrarrestada por los mecanismos homeostáticos corporales. El principal mecanismo de depuración de ácido úrico, xantina y fosfato es la excreción renal y puede precipitar en cualquier parte del sistema colector renal. La capacidad de los riñones para excretar solutos hace poco probable la producción del SLT clínico sin el desarrollo previo de la nefropatía y la consiguiente incapacidad para excretar solutos con la suficiente rapidez como para hacer frente a la carga metabólica.
En el SLT, la lesión tisular inducida por cristales se produce cuando el fosfato de calcio, el ácido úrico y la xantina precipitan en los túbulos renales y causan inflamación y obstrucción. Un nivel elevado de solutos, la baja solubilidad, el flujo lento de la orina y los niveles elevados de sustancias que se unen para cristalizar favorecen la formación de cristales y aumentar la gravedad del SLT. Los niveles elevados de ácido úrico como así de fosfato hacen que los pacientes con SLT tengan un riesgo particularmente elevado de lesión renal aguda por cristales, porque el ácido úrico precipita rápidamente en presencia de fosfato de calcio, y el fosfato de calcio hace lo mismo en presencia de ácido úrico. Por otra parte, el aumento del pH urinario aumenta la solubilidad del ácido úrico pero disminuye la del fosfato de calcio. En los pacientes tratados con alopurinol, la acumulación de xantina, un precursor poco soluble del ácido úrico puede llevar a la nefropatía por xantina o a la litiasis renal, independientemente del pH urinario.
El fosfato de calcio puede precipitar en todo el cuerpo. El riesgo de calcificación ectópica es particularmente elevado en los pacientes que reciben calcio intravenoso. Cuando el fosfato de calcio precipita en el sistema de conducción cardiaca, pueden ocurrir arritmias graves y potencialmente mortales. En el paciente presentado, la lesión renal aguda resultante de la precipitación de cristales de ácido úrico y de fosfato de calcio se vio agravada por la deshidratación y la acidosis que se desarrollaron debido a que el SLT no se había sospechado y no tuvo la atención de apoyo que requería.
Epidemiología
La incidencia y la gravedad del SLT dependen de la masa del cáncer, el potencial de las células tumorales para la lisis, las características del paciente y el tratamiento de apoyo. La variabilidad de las cohortes de pacientes y la falta de criterios uniformes han contribuido a que las denuncias de incidencias sean diferentes. Cuanto mayor es la masa del cáncer, mayor es la cantidad de contenido celular liberada después de la administración del tratamiento oncológico efectivo. Los cánceres con un potencial elevado de lisis celular son los linfomas de alto grado, las leucemias agudas y otros tumores de proliferación rápida. Sin embargo, el potencial de lisis celular se debe considerar junto con la eficacia de la terapia, como lo demuestran los casos de SLT en adultos que murieron después del tratamiento con cetuximab indicado para el carcinoma metastásico de colon, un cáncer en el que el SLT no había sido informado anteriormente. De hecho, este síndrome se reporta cada vez más en pacientes con cánceres que antes rara vez se habían asociado a esta complicación, como el cáncer de endometrio, el carcinoma hepatocelular, la leucemia linfocítica crónica y la leucemia mieloide crónica. Las características de los pacientes que elevan el riesgo son la insuficiencia renal crónica preexistente, la oliguria, la deshidratación, la hipotensión y acidez urinaria. El manejo adecuado de los líquidos influye tanto al desarrollo como en la gravedad del SLT. Por lo tanto, los casos desvastadores de SLT se produjeron en pacientes con cánceres no hematológicos que recibieron un tratamiento efectivo contra el cáncer pero no líquidos por vía intravenosa o no se hizo un seguimiento adecuado debido a que no la presencia del síndrome no fue anticipada. Por el contrario, en muchos países, los pacientes con linfoma de Burkitt voluminoso que tienen un potencial elevado de lisis tienen un riesgo bajo de SLT clínico porque rutinariamente reciben un tratamiento agresivo con hidratación y rasburicasa, una enzima urato oxidasa recombinante, un agente uricolítico altamente efectivo.
Los niños con linfoma de Burkitt que recibieron rasburicasa tuvieron 5 veces menos probabilidad de ser sometidos a diálisis que los niños tratados con alopurinol, lo que ilustra la gran diferencia que puede generar el tratamiento de apoyo, aun cuando los otros factores de riesgo para SLT sean los mismos. Esto es lo que se observó en el niño de 8 años presentado en la viñeta.
| Factores de riesgo de síndrome de lisis tumoral | |
| Masa del cáncer | Volumen del tumor o extensión de la metástasis Infiltración del órgano por las células cancerosas Compromiso de la médula ósea Infiltración renal o obstrucción del tracto de salida |
| Potencial de lisis | Tasa de proliferación de las células cancerosas elevada Potencial de lisis celular Tasa de proliferación de las células cancerosas elevada Sensibilidad de las células cancerosas al tratamiento antineoplásico Intensidad del tratamiento antineoplásico inicial |
| Características previas al cuadro de presentación | Características previas al cuadro de presentación Neuropatía previa al diagnóstico de cáncer Deshidratación o depleción de volumen Orina ácida Hipotensión Exposición a nefrotoxinas |
| Tratamiento de apoyo | Hidratación inadecuada Potasio exógeno Retardo en la eliminación del ácido úrico |
Evaluación de riesgos
La lesión renal aguda se asocia con una elevada morbilidad y mortalidad, y su prevención requiere la conciencia a priori del riesgo de SLT y un cuidadoso control de los primeros signos. Para los adultos con leucemia mieloide aguda y los niños con leucemia linfoblástica aguda tratados con la hidratación y alopurinol (pero no con rasburicasa) se han desarrollado modelos que predicen el riesgo de SLT.
Estos modelos carecen de una definición estándar del SLT, utilizan diferentes puntos finales primarios (es decir, ya sea el SLT clínico o cualquier tipo de SLT), no son estandarizados en cuanto al tratamiento de apoyo y tienen sistemas de puntaje complejos. Los expertos han emitido guías de manejo para el SLT pero se esperan modelos nuevos de orientación más sencillos para predecir el riesgo, que tengan una definición estandarizada del síndrome y una guía uniforme para el tratamiento de apoyo para cada tipo de cáncer.
Manejo
El tratamiento primario del SLT debe considerar la preservación de la función renal como así la prevención de las arritmias y la irritabilidad neuromuscular.
Prevención de la lesión renal aguda
Todos los pacientes en riesgo de SLT deben recibir hidratación por vía intravenosa para mejorar rápidamente la perfusión renal y la filtración glomerular, y minimizar la acidosis (ya que la disminución del pH urinario promueve la precipitación de los cristales de ácido úrico) y la oliguria (un signo ominoso). Esto se logra generalmente con la hiperhidratación con líquidos por vía intravenosa (2.500 a 3.000 ml/m2/día en los pacientes de mayor riesgo). La hidratación es el método preferido para aumentar la diuresis, pero también pueden ser necesarios los diuréticos. En un estudio con un modelo de ratas con nefropatía por ácido úrico con hiperuricemia inducida por la infusión intravenosa continua de dosis elevadas de ácido úrico, aumento de la diuresis por administración de furosemida o diabetes insípida congénita (en el grupo de ratones con esta modificación genética), la protección renal que se logró fue igualmente buena, mientras que la acetazolamida (diuresis leve) y el bicarbonato solo consiguieron una protección renal moderada (no más que una dosis baja de furosemida, sin bicarbonato). Por lo tanto, en los pacientes con diuresis baja después de alcanzar un estado óptimo de hidratación se recomienda el uso de un diurético de asa como la furosemida, para lograr por lo menos una diuresis no menor a los 2 ml/kg/hora.
La reducción del nivel de ácido úrico mediante la administración de alopurinol, y en particular de rasburicasa, puede preservar o mejorar la función renal y reducir los niveles de fósforo sérico, como un efecto secundario beneficioso. Aunque el alopurinol previene la formación de ácido úrico, el ácido úrico ya existente debe ser excretado. El nivel de ácido úrico puede tardar 2 o más días en disminuir, retraso que permite el desarrollo de la nefropatía por ácido úrico. Por otra parte, a pesar del tratamiento con alopurinol pueden acumularse xantinas, dando lugar a la neuropatía por xantina. Dado que el nivel de xantinas en el suero no es una medida de rutina, su efecto sobre el desarrollo del daño renal agudo es incierto. Al impedir la acumulación de xantina y directamente descomponer el úrico ácido, para la prevención y el tratamiento del SLT es más eficaz la rasburicasa que el alopurinol. En un estudio aleatorizado del uso de alopurinol versus rasburicasa en pacientes en situación de riesgo de SLT, el nivel medio del fósforo sérico alcanzó un máximo de 7,1 mg/dL (2,3 mmol por litro) en el grupo rasburicasa (a las 4 horas, la media de los niveles de ácido úrico disminuyó en un 86%, a 1 mg/dL [59.5 mmol / l]) en comparación con 10,3 mg/dL (3,3 mmol/l) en el grupo de alopurinol (a las 48 horas, los niveles medios de ácido úrico disminuyeron 12%, a 5,7 mg/dL [339.0 mmol/l]) . El nivel de creatininemia mejoró (disminuyó) un 31% en el grupo rasburicasa pero empeoró (aumentó) un 12% en el grupo alopurinol. Pui y col. no constataron ningún aumento en los niveles de fósforo ni disminución de la creatininemia entre los 131 pacientes que se encontraban en alto riesgo de SLT y fueron tratados con rasburicasa. Por último, en un estudio multicéntrico con pacientes pediátricos con linfoma de Burkitt en un estadio avanzado, en el que todos los pacientes recibieron idéntico tratamiento de quimioterapia e hidratación agresiva, en Francia, el SLT se presentó en el 9% de 98 pacientes que recibieron rasburicasa y en Estados Unidos, el 26% de los de 101 pacientes que recibieron alopurinol. Solo el 3% de los pacientes franceses requirió diálisis, a diferencia del 15% de los pacientes en Estados Unidos. En el momento del estudio, en Estados Unidos no estaba disponible la rasburicasa.
La alcalinización urinaria aumenta la solubilidad del ácido úrico pero disminuye la solubilidad del fosfato de calcio. Debido a que es más difícil corregir la hiperfosfatemia que la hiperuricemia, en los pacientes con SLT se debe evitar la alcalinización urinaria, sobre todo cuando se dispone de rasburicasa. Se desconoce si la alcalinización urinaria previene o reduce el riesgo de lesión renal aguda en los pacientes que no tienen acceso a la rasburicasa, pero del modelo animal de nefropatía por ácido úrico se deduce que no ofrece beneficios. Si se utiliza la alcalinización, la misma debe ser suspendida al aparecer la hiperfosfatemia. En los pacientes tratados con rasburicasa, las muestras de sangre para la medición del nivel de ácido úrico deben ser colocadas en hielo para prevenir la interrupción ex vivo del ácido úrico por la rasburicasa y por lo tanto dar un nivel bajo falso. Los pacientes con deficiencia de glucosa-6-fosfato deben evitar la rasburicasa ya que el peróxido de hidrógeno, un producto de la degradación del ácido úrico, puede causar metahemoglobinemia y, en los casos graves, anemia hemolítica. La rasburicasa se recomienda como tratamiento de primera línea para los pacientes que están en alto riesgo de SLT. Por consideraciones de costos y a la espera de la realización de estudios de farmacoeconomía todavía no se ha logrado un consenso sobre el uso de la rasburicasa en pacientes con riesgo medio de SLT mientras que algunos han abogado por el uso de una pequeña dosis de rasburicasa en tales pacientes. Los pacientes con riesgo bajo por lo general pueden ser tratados con líquidos por vía intravenosa con o sin alopurinol, pero deben ser supervisados diariamente para detectar los signos del SLT.
Prevención de las arritmias cardíacas y la irritabilidad neuromuscular
La hiperpotasemia sigue siendo el componente más peligroso del SLT ya que puede causar la muerte súbita por arritmia cardíaca. Los pacientes deben limitar la ingesta de potasio y fósforo durante el período de riesgo de SLT. En los pacientes con SLT y lesiones renales agudas se recomiendan la medición frecuente de los niveles de potasio (cada 4 a 6 horas), el monitoreo cardiaco continuo y la administración de sulfonato de sodio de poliestireno oral. La hemodiálisis y la hemofiltración eliminan el potasio en forma efectiva. Como medidas contemporizadoras pueden utilizarse glucosa más insulina o agonistas ß; el gluconato de calcio puede ser utilizado para reducir el riesgo de arritmia mientras se espera la hemodiálisis.
La hipocalcemia puede también poner en peligro la vida por la aparición de arritmias e irritabilidad neuromuscular; el control de la fosfatemia puede prevenir la hipocalcemia. La hipocalcemia sintomática debe ser tratada con calcio en la dosis mínima necesaria para aliviar los síntomas, ya que la administración de cantidades excesivas de calcio aumenta el producto fosfocálcico y su tasa de cristalización, especialmente si el producto es mayor de 60 mg2/m2/dl. La hipocalcemia no se acompaña de signos o síntomas ni requiere tratamiento. A pesar de la falta de estudios que demuestren su eficacia, en pacientes con SLT se suelen dar quelantes de fosfato.
Manejo de la lesión renal aguda grave
A pesar de una atención óptima, en algunos pacientes se desarrollan lesiones renales agudas graves que requieren tratamiento de reemplazo renal. Si bien las indicaciones para el tratamiento de reemplazo renal en los pacientes con SLT son similares a las de los pacientes con otras causas de insuficiencia renal aguda, los umbrales que se utilizan para los pacientes con SLT son un tanto más bajos debido a la liberación y acumulación potencialmente rápida del potasio, en particular en los pacientes con oliguria. En presencia de SLT, la hiperfosfatemia inducida por hipocalcemia sintomática también puede justificar la diálisis. La eliminación del fosfato aumenta a medida que el tratamiento prosigue, lo que ha llevado a algunos a defender el uso de la terapia de reemplazo renal continua en pacientes con SLT, incluyendo la hemofiltración continua venovenosa, la hemodiálisis venovenosa continua o la hemodiafiltración venovenosa continua. Estos métodos de diálisis utilizan filtros de diálisis con un tamaño de poro más grande, lo que permite la eliminación más rápida de las moléculas que no son removidas eficazmente mediante la hemodiálisis convencional. Un estudio que comparó la fosfatemia en adultos con lesión renal aguda tratados mediante la hemodiálisis convencional o la hemodiafiltración venovenosa continua mostró que la hemodiafiltración venovenosa continua es más eficaz para reducir el fosfato. Mucho menos se sabe acerca de la depuración del ácido úrico con la diálisis, pero en los países en los que la rasburicasa está disponible rara vez la hiperuricemia es una indicación de diálisis. En el caso presentado, una vez diagnosticado el SLT, los autores procedieron al tratamiento con líquidos intravenosos, quelantes del fósforo y rasburicasa, impidiendo la necesidad de la diálisis. A pesar de una potasemia de 5,9 mmol por litro, el paciente no tenía arritmia ni alteraciones electrocardiográficas, pero los autores consideran que si se hubiera presentado 1 día después, el SLT pudo haber tenido un resultado fatal.
Seguimiento
La producción de orina es el factor clave para el control de los pacientes que están en riesgo de desarrollar un SLT y de aquellos en los que ya el síndrome se ha desarrollado. En los pacientes cuyo riesgo de SLT clínico no es insignificante, es importante registrar y evaluar la producción de orina y el balance hídrico con frecuencia. Los pacientes de alto riesgo también deben recibir un control intensivo de enfermería, con monitorización cardíaca continua y medición de electrolitos, creatinina, y ácido úrico cada 4 a 6 horas después del inicio del tratamiento. Los pacientes de riesgo intermedio deben tener un control de laboratorio cada 8 a 12 horas, y los de riesgo bajo, dicho control debe hacerse todos los días. El monitoreo debe continuar durante el período durante el cual el paciente está en riesgo de desarrollar el SLT, lo cual depende del régimen terapéutico. Con un protocolo para la leucemia linfoblástica aguda, para la cual se ofreció por adelantado un solo agente terapéutico, el metotrexato, algunos pacientes desarrollaron un nuevo SLT a los 6 o 7 días del tratamiento de inducción-remisión (después del inicio de la quimioterapia de combinación con prednisona, vincristina, y daunorrubicina el día 5 y asparaginasa el día 6).
Disminución de la tasa de lisis tumoral con una fase previa de tratamiento
Los pacientes con alto riesgo de SLT también pueden recibir un tratamiento inicial de baja intensidad. La lisis más lenta de las células del cáncer renal permite la intervención de mecanismos homeostáticos para eliminar los metabolitos antes de que se acumulen y causen daños en los órganos. En los casos de linfoma de células B avanzado no Hodgkin o de leucemia de Burkitt grave se han utilizado dosis bajas de ciclofosfamida, vincristina y prednisona durante 1 semana antes del inicio de una quimioterapia intensa. Del mismo modo, para la leucemia linfoblástica aguda muchos grupos prefieren 1 semana de monoterapia con prednisona.
Fuente: IntraMed